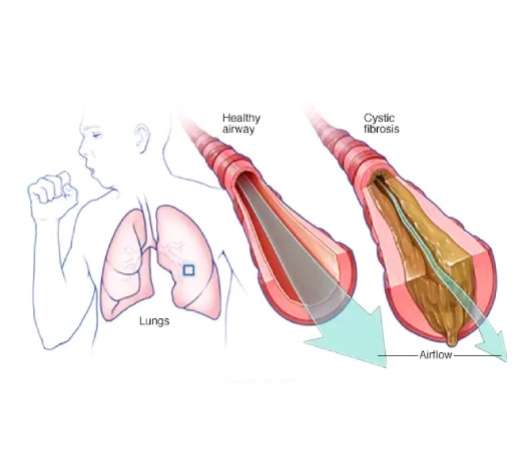
فیبروز کیستیک (CF) یک بیماری ژنتیکی اتوزوم مغلوب است که بر عملکرد غدد برون ریز تأثیر می گذارد. این بیماری با جهش های ژن CFTR مرتبط بوده و موجب اختلال در ترشح کلرید می شود.
مقدمه:
فیبروز کیستیک (Cystic Fibrosis) یکی از بیماری های ژنتیکی پیچیده است که عمدتاً سیستم تنفسی و گوارشی را تحت تأثیر قرار می دهد. این بیماری ناشی از جهش در ژن CFTR است که در تنظیم انتقال یون های کلر در غشای سلولی نقش دارد. اختلال در عملکرد این ژن موجب افزایش غلظت مخاط در مجاری تنفسی و سایر اندام های بدن می شود و مشکلات متعددی را به همراه دارد.
مطالعات نشان می دهند که قدمت فیبروز کیستیک به قرون وسطی بازمی گردد، زمانی که کودکان با تعریق بیش از حد نمک، دچار مرگ زودرس می شدند. با این حال، شناخت علمی این بیماری از دهه 1930 آغاز شد، زمانی که محققان ویژگی های کلینیکی آن را مشخص کردند. در سال 1938، دوروتی اندرسون از دانشگاه کلمبیا برای نخستین بار این بیماری را به عنوان یک اختلال مستقل تشریح کرد و ارتباط آن را با تحلیل عملکرد پانکراس توضیح داد.
پیشرفت های علمی در دهه های بعد، زمینه ساز درک بهتر مکانیسم های مولکولی بیماری شد. در سال 1953، پژوهشگران دریافتند که بیماران فیبروز کیستیک در شرایط گرم، مقادیر بالایی از یون های سدیم و کلر را از طریق تعریق دفع می کنند. این کشف منجر به توسعه آزمایش تعریق، که به عنوان یک روش استاندارد برای تشخیص بیماری مورد استفاده قرار گرفت، شد.
تحقیقات ژنتیکی در سال 1989، با کشف ژن CFTR و توالی یابی آن، نقطه عطفی در شناخت جهش های مرتبط با این بیماری محسوب می شد. این ژن که روی بازوی بلند کروموزوم 7 قرار دارد، مسئول تولید یک پروتئین کانالی انتقال کلر است که در سلول های بافت های مختلف بدن نقش حیاتی دارد. پس از شناسایی ژن CFTR، بیش از هزار جهش مختلف در آن کشف شد که هر کدام تأثیر متفاوتی بر شدت علائم بیماری دارند.
تنوع جهش های ژنی در مناطق مختلف جغرافیایی و نژادهای گوناگون، چالش های جدیدی را در تشخیص و درمان این بیماری ایجاد کرده است. برخی جهش ها باعث کاهش شدید عملکرد پروتئین CFTR شده و موجب ایجاد علائم شدید می شوند، در حالی که جهش های دیگر ممکن است تأثیر ملایم تری داشته باشند. درک این جهش ها نقش مهمی در توسعه روش های نوین درمانی دارد.
امروزه، مطالعات ژنتیکی و روش های مولکولی پیشرفته به پزشکان امکان داده اند تا جهش های خاص این بیماری را با دقت بیشتری شناسایی کرده و استراتژی های درمانی بهینه را برای بیماران تدوین کنند. شناخت دقیق جهش های ژنی در فیبروز کیستیک، مسیر تحقیقات پزشکی را به سوی یافتن راهکارهای مؤثرتر برای مدیریت و کنترل این بیماری هدایت کرده است.
تاریخچه فیبروز کیستیک (CF):
در دوران قرون وسطی، اعتقاد بر این بود که کودکانی که پوستی شور دارند دچار نفرین شده اند، زیرا اغلب این کودکان دچار مرگ زودرس می شدند. در آن زمان، فیبروز کیستیک یک بیماری ناشناخته محسوب می شد.
از سال 1930، این بیماری به عنوان یک اختلال مستقل شناخته شد. در سال 1938، دوروتی اندرسون از دانشگاه کلمبیا برای نخستین بار علائم و نشانه های این بیماری را به طور کامل توصیف کرد. او فرض کرد که مشکلات گوارشی و کمبود ویتامین A در بیماران مبتلا به CF ناشی از تحلیل عملکرد پانکراس است. به همین دلیل، این بیماری با نام فیبروز کیستیک پانکراس شناخته شد.
در سال 1947، این بیماری به عنوان یک اختلال وراثتی با الگوی توارث اتوزوم مغلوب شناخته شد. سپس در سال 1953، دی سنت اگنس از دانشگاه کلمبیا پس از مشاهده کم آبی شدید بیماران CF در هوای گرم نیویورک، به متخصصان اطفال گزارش داد که این بیماران مقادیر زیادی یون های سدیم و کلر را از طریق تعریق دفع می کنند. این یافته منجر به توسعه تست عرق یونتوفورز به عنوان روش استاندارد تشخیص CF شد.
در دهه 1980، دانشمندان به وجود اختلالات بافتی و تحلیل سلولی در این بیماری پی بردند. سرانجام، در سال 1989، تیمی به سرپرستی تسوی و ریوردان از بیمارستان کودکان تورنتو، ژن CF را کشف کرده و محصول پروتئینی آن را CFTR نام گذاری کردند. این ژن که روی بازوی بلند کروموزوم 7q نقشه برداری شد، از کتابخانه cDNA بافت ریه و غدد عرق استخراج گردید.
در همان سال، شایع ترین جهش این ژن یعنی ΔF508 همراه با توالی cDNA آن شناسایی شد. کشف ژن CFTR منجر به بررسی های گسترده تری درباره جهش های مختلف آن و توسعه روش های مولکولی برای تشخیص و درمان بیماران شد. از سال 1989 تاکنون، بیش از 1000 جهش در ژن CFTR شناسایی شده است که میزان شیوع آن ها بسته به عوامل جغرافیایی و نژادی متغیر است.
تشخیص ژن فیبروز کیستیک (CF)
در ابتدا، به دلیل شیوع بالای فیبروز کیستیک (به ویژه در میان سفیدپوستان) و درک محدود از پاتوفیزیولوژی آن، این بیماری به عنوان هدفی برای کلونینگ موقعیتی در نظر گرفته شد. ازآنجاکه هیچ ناهنجاری کروموزومی مشخصی برای این بیماری یافت نشد، دانشمندان از مطالعات پیوستگی برای تعیین محل و کلون کردن ژن عامل بیماری استفاده کردند.
دو عامل کلیدی در موفقیت این مطالعات نقش داشتند: نخست، تک ژنی بودن بیماری که پیچیدگی مطالعات پیوستگی در بیماری های چندژنی را کاهش داد، و دوم، وجود تعداد زیادی از خانواده های مبتلا که امکان بررسی پیوستگی ژنی را با استفاده از نشانگرهای چندشکلی فراهم کرد و در نهایت محل ژن مشخص شد.
در سال ۱۹۸۵، ارتباط بین فیبروز کیستیک و چندشکلی پروتئین آنزیم پاراکسوناز شناسایی شد. پس از بررسی گسترده خانواده های مبتلا و مطالعه صدها نشانگر ژنومی، ارتباط یک نشانگر DNA روی بازوی بلند کروموزوم ۷ به نام D7515 با جایگاه ژن CF تأیید شد و مشخص گردید که ژن CF در ناحیه میانی این بازو قرار دارد.
مطالعات پیوستگی بیشتر، دو نشانگر نزدیک تر به ژن CF را شناسایی کرد: پروتوانکوژن MET و D758. پروتوانکوژن MET به عنوان نشانگر جلویی و D758 به عنوان نشانگر عقبی مشخص شد. این کشف موقعیت ژن CF را در ناحیه 7q31-32 تعیین کرد. بررسی های بعدی نشان داد که فاصله بین ژن CF و نشانگر D758 حدود ۱ تا ۲ سانتی مورگان و فاصله بین MET و D758 تقریباً ۱.۵ مگاباز است.
در مرحله بعد، با استفاده از روش های نقشه برداری اشباع، دو نشانگر نزدیک تر به ژن CF به نام های D75340 و D75122 شناسایی شدند. پس از مرتب سازی این نشانگرها با روش های فیزیکی و ژنتیکی، ترتیب آن ها به صورت D758 – D75122 – D75340 – MET مشخص شد.
سپس، با بهره گیری از تکنیک های نقشه برداری فیزیکی مانند قدم زدن کروموزومی و پرش کروموزومی، نواحی مجاور ژن CF همراه با نشانگرهای مرتبط کلون شد. این ناحیه حدود ۲۸۰ کیلوباز طول داشت و برای تعیین ژن عامل بیماری مورد بررسی قرار گرفت. دانشمندان با استفاده از آنزیم های محدودکننده، قطعه ای ۳۸۰ کیلوبازی را که ژن CF را در بر می گرفت، شناسایی کردند.
از آنجا که بیشتر بخش های DNA رونویسی نمی شوند، لازم بود از روش هایی برای تشخیص توالی های کدکننده استفاده شود. به همین منظور، از روش Zooblot برای بررسی توالی های حفاظت شده میان گونه های مختلف بهره گرفته شد. این مطالعات چهار توالی نسخه برداری شده را شناسایی کرد که یکی از آن ها دارای ناحیه ای غنی از CpG بود. این نواحی معمولاً در نزدیکی لبه ژن های فعال قرار دارند.
در ادامه، با بررسی کتابخانه های مختلف cDNA، یک کلون cDNA از غدد عرق و ریه جداسازی شد که یک رونوشت ۶.۵ کیلوبازی mRNA را در روش لکه گذاری نوردن از RNA همین غدد شناسایی می کرد. سپس، با استفاده از این cDNA به عنوان الگو، چندین کلون دیگر که دارای همپوشانی بودند، جداسازی شد و ناحیه کدکننده ژن CF مشخص گردید.
درنهایت، با مقایسه توالی ژن در بیماران مبتلا و افراد سالم، یک حذف سه تایی در کدون ۵۰۸ کشف شد که منجر به حذف اسید آمینه فنیل آلانین در موقعیت ۵۰۸ پلی پپتید شد. این جهش که با نام ΔF508 شناخته می شود، در حدود ۷۰ درصد کروموزوم های حامل CF یافت شد و در هیچ یک از کروموزوم های طبیعی دیده نشد، که نشان داد این ژن به طور مستقیم در بیماری فیبروز کیستیک نقش دارد.
این کشف نقطه عطفی در درک فیبروز کیستیک بود و به توسعه روش های مولکولی برای مطالعه جهش های این ژن و یافتن راهکارهای درمانی منجر شد. از سال ۱۹۸۹ تاکنون، بیش از ۱۰۰۰ جهش در ژن CFTR شناسایی شده است که فراوانی آن ها بسته به شرایط جغرافیایی و نژادی متفاوت است.
تأیید تشخیص ژن CF
شواهد متعددی نشان داد که ژن شناسایی شده در بروز بیماری CF نقش دارد:
1- بیان ژن در بافت های مختلف: بررسی های نادرن RNA نشان داد که رونویسی این ژن در شش ها، کولون، غدد عرق، جفت و کبد به میزان برابر صورت می گیرد، اما در پانکراس و پولیپ های بینی افزایش یافته و در مغز، غدد فوق کلیوی و فیبروبلاست ها مشاهده نمی شود. این یافته ها نشان داد که ژن CF عمدتاً در بافت هایی که در بیماران CF تحت تأثیر قرار می گیرند، بیان می شود. بنابراین، میان الگوی بیان این ژن و پاتولوژی بیماری ارتباط مشخصی وجود دارد.
2- شناسایی جهش های مرتبط با CF: علاوه بر جهش ΔF508 که در 70 درصد کروموزوم های جهش یافته مشاهده شد و در هیچ یک از کروموزوم های سالم یافت نشد، چندین جهش دیگر نیز در ژن CFTR بیماران مبتلا به CF شناسایی شد. این موضوع نشان می دهد که تغییرات ژنتیکی در CFTR عامل اصلی بیماری است.
3- تأثیر اصلاح ژنتیکی بر سلول های بیمار: زمانی که DNA حاوی ژن CFTR کامل به سلول های کشت شده از مجاری تنفسی و پانکراس بیماران منتقل شد، نقص عملکردی این سلول ها برطرف گردید. این آزمایش ها به طور مستقیم نقش ژن CFTR در بیماری CF را تأیید کرد.




























